Gタンパク共役型受容体の最近の動向
医学のあゆみ 194巻p. 241、 2000.7.29号より
はじめに
Gタンパク共約型受容体(以下、GPCR, G-protein-coupled receptorの略)は全部で何種類あるのであるのか、と言う疑問に対する直接の答えはない。線虫のゲノムを解析したところ、約5%がGPCRであることから、おそらくヒトでも同程度、すなわち、5,000個程度は存在すると推定されている(そのうち、偽遺伝子がどの程度占めるかは明らかでない)。別の研究から典型的なGPCRの一つである嗅覚受容体の種類は約1,000と報告されており、5,000と言う数は概ね妥当な数と思われる。言うまでもなく、GPCRはその構造上特徴がはっきりしているため、おそらく2年以内には、全てのGPCRの全構造が明らかになると思われる。GPCRの研究は現在極めて精力的に進められている。それは、以下に述べるように次々と新たな事実が発見されたことが、基礎研究者の興味を惹いていることに加えて、GPCRが巨大な創薬のターゲットと考えられている故である。現在、約1,500個のGPCRが構造を決定されているが、そのうち、リガンドが同定されているものはわずかに30%にすぎない。残りの大部分はいわゆる孤児受容体(オーファンレセプター)として残り、どの受容体を選び、天然リガンド探しを始めるか、また、拮抗薬のスクリーニングを始めるか、いま、各研究者の知恵が問われている時である。
興味ある受容体のクローニング
長年、その存在が示唆されながら単離できなかった遺伝子が次々と単離されている。以下にいくつかの典型的な例を紹介しよう。
H3受容体
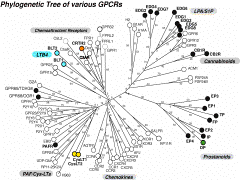
ヒスタミンH3受容体の存在は15年以上前から想定されていたが、多くの研究者はH1,H2との相同性を重視するあまり、H3の単離に成功していなかった。Lovenbergのグループは種々のアミン性受容体のスクリーニングの過程で、視床下部ライブラリーよりムスカリン性アセチルコリン受容体(M2)と相同性を持つ新規の受容体を単離し、哺乳動物細胞に発現させたとき、これはH3の性質を示すことが明らかとなった。その後、これをプローブにさらにアイソフォームが存在することも明らかとなったが、左図に示すごとく、受容体の構造の相同性はリガンドの性質だけでなく、細胞内シグナルに依存することを示す良い例と言えよう。これにより、脳におけるヒスタミンの機能や、また、ねむけを起こさない抗ヒスタミン剤の開発への足がかりが出来たこととなる。
ロイコトリエン受容体
プロスタグランディン受容体が京大のグループにより単離されていった過程で、当然次の目標はロイコトリエンB、およびDの受容体となった。プロスタグランディンとロイコトリエンはアラキドン酸から合成されるエイコサノイドであり、当然、細胞膜貫通部のいくつかの保存されている部分をプライマーとしたRT-PCRが行われた。しかし、クローニングは別の方法で行われた。すなわち、筆者のグループでのロイコトリエンB4受容体クローニングは、HL-60における受容体発現量がレチノイン酸分化により大きく変化することに注目したサブトラクションクローニングにより得たcDNAの一つがこの受容体であることが明らかとなった。この場合、cDNA断片はORF(翻訳領域)からはずれており、既にEST (expression sequence tag)にこの断片を含むGPCRが登録されていることが助けとなったことは明記すべきことである。ロイコトリエンB4受容体はCHO細胞に発現させると化学走性を示すことより、臨床への応用が進んでいる。最近、横溝らは、さらにロイコトリエンB4の第二受容体を発見した。
他方、気管支喘息のメディエーターと考えられているロイコトリエンD4受容体(薬理学的にはCys-LT1と命名される)はメルク及びスミスクラインビーチャムの両研究所から発表された。これは彼らの持つ孤児受容体リガンド探しプログラムの一環である。細胞内シグナル分子の明らかでない受容体やリガンドを探すため、メルクのグループはカエルの色素細胞を用いた。本手法はcAMPの増加、現象のいずれをも色素細胞での色素の凝集、解離で見ることが出来るので、マルチウエルプレートを用いたいわゆるhigh throughput assayに適していると言えよう。スミスクラインビーチャムの研究グループはこの受容体がロイコトリエンC、Dに反応することは既に見いだし、98年には既に欧州特許にはその内容を記載していた。彼らが、これを文献にしたのはずっと後のことになるが、この理由については反応性が著しく悪いからである。おそらく後述するような細胞膜への輸送か、あるいは何らかのコンポーネントがかけている可能性が高い。
LPA受容体
細胞培養時に血清(血漿は効果が低い)が必要で、これは血小板に由来する何らかの増殖因子があることは以前より指摘されていた。一つは血小板由来増殖因子(platelet-derived growth factor, PDGF)であるが、今ひとつが、極めて単純なリン脂質であるLPAである。LPAは血清中では数十μM濃度あると言われており、これは純品のLPAでも同じような細胞増殖作用を示すことが出来る。LPAはこの他、細胞の分化、あるいはニューロンの軸索退縮など多彩な作用を持っており、その受容体の単離が待望されていた。1996年、米国のJerold Chun一派は、発生初期における神経細胞の遊走を司る因子を探す中で、脳室周囲(ventricular zone)に発現する受容体を探索する中で、その一つがLPAと反応することを見いだした。本受容体はvzg-1と名付けられたが、91年にTim Hlaが孤児受容体として見いだしていたヒトのedg-1受容体、さらにedg-2受容体との相同性があることから、vzg-1/edg-2と名付けられ、その後芋蔓式にこのファミリーが単離された。現在、edg-1からedg-8までが同定されており、それぞれ、発現部位やリガンド特異性に違いがあるものの、LPAあるいはスフィンゴシン1リン酸(S1P, Sph-1-Pと略)に対する受容体と考えられている。図1で見られるように、スフィンゴシン1リン酸受容体(Edg1,3,5,6,8)とLPA受容体(Edg-2,4,7)は相同性の上でも二つのグループにきれいに別れている。
種々の孤児受容体のリガンド探し
これについては、スペースの関係で詳細は省くが、オレキシン受容体、プロラクチン放出ペプチド受容体など多数にわたり、それぞれにリガンド探しの工夫が認められる。オレキシン受容体の異常がナルコレプシーと関連するという柳沢らの知見は、同氏のエンドセリン受容体異常がHirschspurung病と関連するという知見とあわせて、GPCRの構造異常が疾患に結びつくという極めて貴重な報告と言えよう。
受容体の動き、ソーティングとインターナリゼーション機構
ところで、GPCRはリボソームでタンパク合成され、ゴルジ装置で糖鎖などの付加を受けた後、どの様にして細胞膜へ正しくソーティングされるのであろうか。大部分のGPCRはいわゆるシグナルペプチドを持たない。従って、この受容体を細胞膜、しかも、特定の部位へ運搬する何らかの分子機構(シャペロン様分子)が存在するはずである。これについては、多くのことが未解決のままである。これが解決されないと、単離した遺伝子の機能を明らかにすることは困難を伴う。実際、実験室レベルでは受容体のN末端にタグをつけ、セルソーターなどで細胞膜外への発現を確認したり、また、いくつかの会社からはシグナルペプチドを予めベクターに組み込んだものが作られ、細胞膜への発現を助けている。現在のところ、細胞膜輸送機構をを説くカギと思われる二つの知見がある。
RAMPは運搬とリガンド特異性を決める分子
カルチトニンとアドレノメデュリンはいずれも構造の似たしかし、作用の異なるペプチドであるが、その受容体は明らかでなかった。カルシトニン受容体様受容体(calcitonin receptor like receptor, CRLR)はそれ自身を細胞に発現させてもいずれのリガンドにも明らかなレスポンスは認めなかったが、細胞膜を一回貫通するタンパク(RAMP, receptor activity modifying protein, 現在1~3まで知られている)を共発現すると細胞膜への輸送と、リガンドの特異性を決めることが明らかとなった。すなわち、RAMP-1はCRLRと共にCGRP受容体を構成し、類似の分子であるRAMP-2は同じCRLRと結合し、アドレノメデュリン受容体を構成する。驚くべきことに、リガンドは膜8回貫通分子と結合するのである。RAMPに関する研究は現在非常に活発に進められている。
嗅覚受容体におけるodr-4の機能
嗅覚神経の場合、さらに興味深い。生後も30日を寿命として、幹細胞よりの再生を続けるこのニューロンには単一の嗅覚受容体が発現している。1000個ある受容体の中で、ただ一つがしかもアレル排除を行い発現している。この機構も興味深いが、他の神経細胞と同様に細胞は著しい極性を持ち、受容体は核周囲で作られた後、微繊毛(シリア)の存在する樹状突起へと運ばれる。嗅粘膜上皮細胞における受容体運搬分子の研究は線虫の遺伝学で始まった。すなわち、線虫での化学走性の研究をしていたBergmanのグループは嗅覚(化学)受容体であるodr-10を繊毛へ運ぶ分子として一回膜貫通型のodr-4を見つけた。Odr-4は受容体の運搬には関係するが、同じく繊毛に発現するGタンパク質(Golf)あるいはアデニル酸シクラーゼには関与しない。つまり、受容体特異的運搬分子と言うことになる。ちなみに、このodr-4と先のRAMPの間にはホモロジーは存在しない。哺乳動物嗅覚受容体のRAMP様分子、あるいは、odr-4様分子の探索は進められているが、現在のところ、その報告はない。1000の受容体分子が異なる運搬分子を持つのか、あるいは、一つの分子で事足りるかももちろん明らかではない。
ヘテロダイマー
多くのイオンチャネルや増殖因子受容体は二量体構造を有していることは良く知られている。最近の知見では、多くのGPCRもホモ二量体を形成していると考えられるようになった。我々がクローニングしたPAF受容体も電気泳動では、単量体と二量体相当の部位にバンドが検出される。最近の興味ある知見としては、いくつかの受容体はヘテロ二量体構造を作ると言うことである。
GABA (B) 受容体のヘテロ二量体
ガンマアミノ酪酸(γ-aminobutyric acid, GABA)はタイプA受容体やタイプC受容体と結合し、受容体クロライドチャネルを開口する。こうして、細胞膜の過分極による神経伝達の抑制を行う。しかし、GABAはGPCRにも結合し、ポタシウムチャネルなどを開口することも知られており、これをGABA(B)受容体とよばれている。しかし、脳における内因性の受容体と比べて単離された受容体のチャネル修飾能は著しく弱かった。1998年12月号のネーチュア誌に出た三つの論文はRAMPとは異なる別の仕組みで受容体が細胞膜上で機能することを証明する大きな成果であった。K. A. Jonesらは既にクローニングされているGABA(B)R1と相同性の高いcDNAをESTデータベースから、また、FH Marshall(Glaxo)のグループは同じ受容体の細胞質テイルを餌に酵母のツーハイブリド系で、Bettler らは同じくESTデータベースを利用して相同性クローンを拾うと言う方法で、いずれもGABA(B)R2なる分子を得た。GABA(B)R2はリガンドやアンタゴニストとの結合能力はないが、R1とヘテロ二量体を形成することにより、ポタシウムチャネル活性化など、全ての機能を担うことが出来る。この二つの分子が実際に一つのニューロンの樹状突起に存在していること、また、生体内でもおそらく二量体を作っていることは免疫沈降などの実験から確かめられた。この三つの衝撃的業績がいずれも企業の研究所でなされたと言うことは興味深い。同様のヘテロ二量体によるGPCRの活性化はオピオイド受容体でも、また、ドーパミン受容体(DR2)とソマトスタチン受容体(SSTR5)のヘテロ二量体でも報告がなされている。実際のニューロンでこの様な形の相互作用があるか、否かは今後の問題である。
おわりに
今回は、枚数の都合で省略したが、GPCRの細胞内移行に関してC末端のPZDドメインが重要な役割を果たすとの報告、また、Gタンパクの中でもG12,13が直接低分子量Gタンパク質を活性化するとの報告 、また、それまで、別系統と考えられていたチロシンキナーゼ系とGPCR系のクロストークもpyk分子を会して可能となった。さらに、核膜にGPCRやGタンパク質が存在するとの報告もなされている。GPCRの研究は一時、隆盛期を過ぎたような論調がなされたが、最近は核への情報伝達を含めて、細胞内シグナル伝達の中心にどっかと腰を落ち着けている感じがする。RAMP、odr-4の発見やGABA(B)受容体のヘテロダイマーの発見は非常に大きなインパクトを与えた。しかし、ヘテロダイマーを作る役は誰が果たしているのだろうか。また、RAMPを膜へ運ぶ力は何なのか?また、新たな謎が浮かぶ。さらに、ロドプシンを初めとするGPCRの大量発現と結晶のX線解析はアゴニスト、アンタゴニストがいかに異なる働きをするかの解明を含めて、GPCR研究の次の大きなブレークスルーを生み出すであろう。
キーワード:孤児受容体(オーファンレセプター)、細胞膜への輸送、ヘテロ二量体、クロストーク

