高度多剤耐性緑膿菌の分子疫学研究およびその検出のための迅速診断キットの開発
当研究部は、日本を含むアジアの医療施設から分離された緑膿菌の分子疫学調査を行っています。日本の医療施設からはアミノ配糖体耐性遺伝子aac(6')-Iaeや、カルバペネム耐性遺伝子blaIMP-1を保有している高度多剤耐性緑膿菌NCGM2.S1を見出し、その近縁株が日本全国の医療施設で流行していることを明らかにしました。また、ベトナムやネパールの医療施設からは高度アミノグリコシド耐性に関与する16S rRNAメチラーゼ産生多剤耐性緑膿菌が多く分離されることを見出しました。
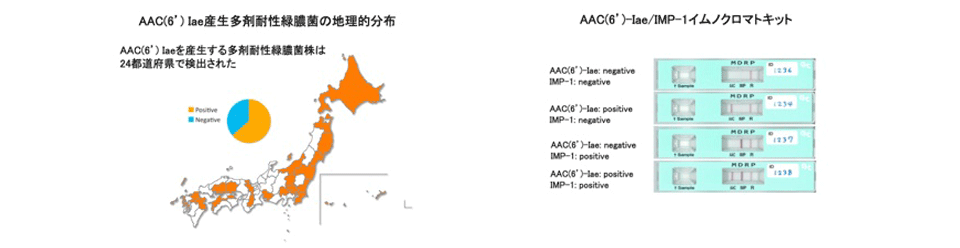
当研究部は、日本で分離される多くの高度MDRPが保有するアミノ配糖体耐性タンパク質AAC(6')-Iae及びIMPメタロβラクタマーゼを迅速に検出するイムノクロマト法を開発しました。2012年度のMDRP分子疫学調査により、従来とは異なるアミノ配糖体耐性タンパク質AAC(6')-Ib産生高度MDRPが増加していることを明らかにしました。このアミノ配糖体耐性タンパク質AAC(6')-Ibを検出するイムノクロマト法を開発することで、より多くの高度MDRPを迅速に検出できるようになりました。
当研究部が行った日本全国の多剤耐性緑膿菌(MDRP)の疫学調査により、(1)MDRPの中でも各種抗菌剤にさらに耐性化した高度MDRPが全国に分布していること、(2)高度MDRPの95%がaac(6')-IaeまたはblaIMP-1を保有すること、(3)新たな遺伝的背景をもつ高度MDRPのクラスターが出現してきたことが明らかになりました。さらに、当研究部が開発した各種イムノクロマト法を用いることで、薬剤感受性試験に頼らず、迅速かつ簡便に高度MDRPを検出できることを証明しました。
主要参考文献
- Oshiro S 2015 in J Microbiol Methods. 118: 159-163
- Tada T 2014 in BMC Infectious Diseases 14:56
- Tada T 2014 in Antimicrobial Agents and Chemotherapy 58 (6) p3538-3540
- Tada T 2014 in Antimicrobial Agents and Chemotherapy 58 (5) p2916-2920
- Tada T 2013 in International Journal of Antimicrobial Agents 42 (4) p372-324
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (9) p4427-4432
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (5) p2394-2396
- Tada T 2013 in BMC Infectious Diseases 13(1) 251
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (1) p96-100
- Tada T 2012 in Journal of Microbiological Methods 91 (1) p114-116
- Kitao T 2012 in International Journal of Antimicrobial Agents 39 (6) p518-521
- Kitao T 2011 in Journal of Microbiological Methods 87 (3) p330-337
- Kitao T 2010 in Journal of Antimicrobial Chemotherapy 65 (7) p1382-1386
- Sekiguchi J 2005 in Antimicrobial Agents and Chemotherapy 49 (9) p3734-3742
結核菌の疫学研究に基づく薬剤耐性迅速診断キットの開発と抗結核薬耐性機序の解明
当研究部は、ピラジナミドやイソニアジド、フルオロキノロン耐性に関与する結核菌の遺伝子変異を同定し、薬剤耐性機序を明らかにする研究を推進してきました。主要な抗結核薬4剤(リファンピシン・イソニアジド・ピラジナミド・フルオロキノロン)にたいする、病院検査室で実施可能なラインプローブ法による薬剤耐性結核診断法を開発しました。さらに、結核菌を含む抗酸菌4種の同定が出来るラインプローブ法も作成しました。これらのランプローブ法を用いて、多施設による評価試験を実施しました。迅速診断法の開発を通して、結核薬感受性試験の分野における遺伝子診断法の実用化を推し進めています。
当研究部は、結核の第一選択薬であるイソニアジドに耐性をしめすイソニアジド耐性結核菌の疫学調査を行い、既知のイソニアジド耐性に寄与する変異をもたない結核菌を同定しました。我々が調査したイソニアジド耐性結核菌の4%の結核菌は、イソニアジドを活性化するタンパク質KatG遺伝子のプロモーター部位が変異しており、この変異がイソニアジド耐性に寄与していました。一方、これらのイソニアジド耐性結核菌の19%が、イソニアジドの標的であるミコール酸合成酵素inhA遺伝子の上流にあるmabA遺伝子に変異をもっていました。我々は、この変異により新たなプロモーターが生み出されて、下流のinhA遺伝子の発現が上昇し、イソニアジド耐性になることを証明しました。上述のように、現在までに、我々は2つの新たなイソニアジド耐性機構を解明しています。

主要参考文献
- Ando H 2014 in Molecular Microbiology 91 (3) p538-547
- Ando H 2011 in Molecular Microbiology 79 (6) p1615-1628
- Ando H 2011 in Journal of Medical Microbiology 60 (2) p184-188
- Ando H 2010 in Antimicrobial Agents and Chemotherapy 54 (5) p1793-1799
- Ando H 2009 in Clinical Microbiology and Infection 16 (8) p1164-1168
- Sekiguchi J 2007 in Journal of Clinical Microbiology 45 (9) p2802-2807
- Sekiguchi J 2007 in Journal of Clinical Microbiology 45 (1) p179-192
H5N1型高病原性トリインフルエンザを含むインフルエンザ検出キットの開発
当研究部は、ベッドサイドで実施可能な高病原性トリインフルエンザの迅速診断キットの開発を行いました。すでにこのキットの試作品が完成しています。このキットは、免疫クロマトグラフィーを応用した簡易検査キットです。これまではH5N1型高病原性トリインフルエンザの有無の判定に6時間かかっていましたが、これを用いると15分で結果の判定ができるため、検査時間を大幅に短縮できるようになりました。
2009年に流行したH1N1季節性インフルエンザのラインプローブ法による診断キットや、抗インフルエンザ薬耐性に寄与するH274Y変異の検出キットも作成しています。

主要参考文献
- Miyoshi-Akiyama T 2012 in Journal of Virological Methods 185 (2) p276-280
- Miyoshi-Akiyama T 2012 in Influenza and Other Respiratory Viruses 6 (6) p434-441
- Kawachi S 2011 in Journal of Clinical Virology 51 (1) p68-72
- Miyoshi-Akiyama T 2010 in Journal of Clinical Microbiology 48 (3) p703-708
劇症型レンサ球菌感染症の研究
当研究部では、日本国内でレンサ球菌性の侵襲性感染症患者から多く分離されるG群レンサ球菌Streptococcus dysgalactiae subsp. equisimils(SDSE)のゲノム配列を世界に先駆けて解読しました。菌種がSDSEと同じであるが抗原性がことなる、C群レンサ球菌SDSEのゲノム配列も解読しました。
我々は、侵襲性感染症マウスモデルを用いて、G群レンサ球菌が侵襲性感染症を引き起こす際に重要な因子をマイクロアレイ解析により明らかにしました。日本国内で流行しているstG6792型菌が溶血毒素ストレプトリジンを多く産生していることも証明しました。
主要参考文献
- Ogura K in 2017 J Genomics. 5:71-74
- Watanabe S 2016 in Microbiol and Immunol 60(1) p1-9
- Watanabe S 2013 in Genome Biology and Evolution 5 (9) p1644-1651
- Watanabe S 2013 in Journal of Infectious Diseases 208 (9) p1482-1493
- Miyoshi-Akiyama T 2012 in Journal of Bacteriology 194 (19) p5466
- Okumura K 2012 in BMC Genomics 13, 404
- Shimomura Y 2011 in BMC Genomics 12, 17
病原体全ゲノム情報に基づく疫学解析
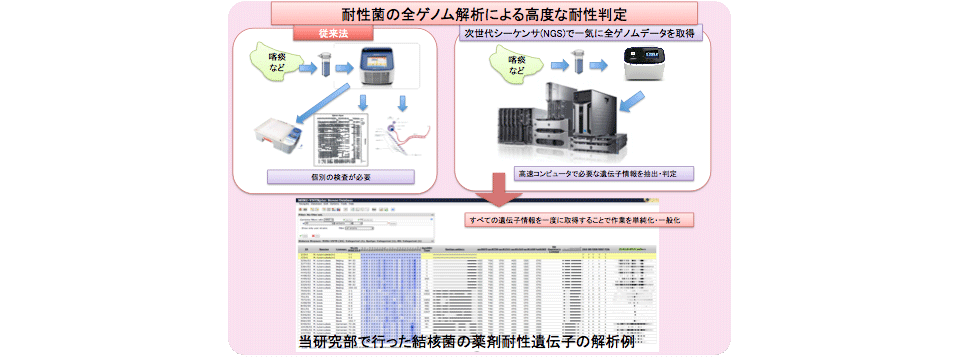
当研究部では、次世代シークエンサーを活用した病原体の全ゲノム情報に基づく疫学解析を実施しております。さらに、ゲノム情報が未解明な病原体の全ゲノム解析も行っております。
主要参考文献
- Tada T 2017 in Antimicrob Agents Chemother. pii: AAC.01806-17.
- Uechi K 2017 in J Infect Chemother. pii: S1341-321X(17)30208-8
- Shrestha B 2017 in Antimicrob Agents Chemother. pii: AAC.01425-17
- Tada T 2017 in BMC Infect Dis.17(1):467
- Tada T 2017 in Antimicrob Agents Chemother. 61(9). pii: e00694-17.
- Tada T 2017 in Int J Infect Dis. 63:72-73
- Tada T 2017 in Int J Infect Dis.63:21-22.
- Ogura K 2017 in J Genomics. 2017 5:71-74
- Tada T 2017 in BMC Infect Dis. 2017 Jul 4;17(1):467
- Tada T 2017 in Antimicrob Agents Chemother. 61(3). pii: e02300-16.
- Miyoshi-Akiyama T 2016 in mSphere. 1(5). pii: e00289-16
- Hayakawa K 2016 in American Journal of Infection Control. 44(11):e257-e259.
- Tada T 2016 in Antimicrob Agents Chemother. 60(11):6853-6858
- Shrestha S 2016 in J Nepal Health Res Counc.14(33):72-76
- Watanabe S 2016 in Microbiol and Immunol 60(1):1-9
- Tada T 2016 in PLoS One 11(4):e0149385
- Matono T 2016 in BMC Res Notes 9(1):197
- Oshiro S 2015 in J Microbiol Methods. 118: 159-163
- Shrestha B, Tada T 2015 in Antimicrob Agents Chemother. 59(9): 5847-5850
- Iwai H 2015 in Tuberculosis 95 (6) p843-844
- Tada T 2015 in BMC Infect Dis 15:433
- Shrestha B 2015 in JNMA J Nepal Med Assoc. 53(198) p89-95
- Tada T 2015 in Antimicrob Agents Chemother 59 (11) p7090-7093
- Shrestha S 2015 in Int J Antimicrob Agents 46(5) p 526-531
- Tada T 2015 in Microb Drug Resist 22(2) p103-108
- Nhung PH 2015 in J Infect Chemother 21(8) p 617-619
- Iwai H 2015 in Tuberculosis 95(3)p246-250
- Sherchan JB 2015 in Antimicrobial Agents and Chemotherapy 2015 Mar 30. [Epub ahead of print]
- Miyoshi-Akiyama T 2015 in Tuberculosis 95(1): 37-39
- Okumura K 2015 in BMC Genomics 16(1): 218
- Kato-Miyazawa M 2015 in Clinical Microbiology and Infection 21(3): 248.e1-248.e8.
- Tojo M 2015 in Journal of Infection and Chemotherapy 21(3): 212-214.
- Tada T 2014 in BMC Infectious Diseases 14:56
- Tada T 2014 in Antimicrobial Agents and Chemotherapy 58 (6) p3538-3540
- Hayakawa K 2014 in Antimicrobial Agents and Chemotherapy 58(6) p3441-3450
- Tada T 2014 in Antimicrobial Agents and Chemotherapy 58 (5) p2916-2920
- Ando H 2014 in Molecular Microbiology 91 (3) p538-547
- Arai R 2014 in BJournal of Veterinary Medical Science 76(6) p491-498
- Tada T 2013 in International Journal of Antimicrobial Agents 42 (4) p372-324
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (9) p4427-4432
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (5) p2394-2396
- Tada T 2013 in BMC Infectious Diseases 13(1) 251
- Miyoshi-Akiyama T 2013 inPLoS ONE 8(6): e66358
- Tada T 2013 in Antimicrobial Agents and Chemotherapy 57 (1) p96-100
- Watanabe S 2013 in Genome Biology and Evolution 5 (9) p1644-1651
- Miyoshi-Akiyama T 2012 in Journal of Bacteriology 194 (20) p5692
- Miyoshi-Akiyama T 2012 in Journal of Bacteriology 194 (19) p5466
- Okumura K 2012 in BMC Genomics 13, 404
- Okumura K 2012 in Journal of Bacteriology 194 (11) p3014
- Miyoshi-Akiyama T 2012 in Journal of Bacteriology 194 (10) p2770
- Miyoshi-Akiyama T 2011 in Journal of Bacteriology 193 (24) p7010
- Miyoshi-Akiyama T 2011 in Journal of Bacteriology 193 (23) p6792
- Tada T 2011 in Journal of Bacteriology 193 (22) p6397
- Okumura K 2011 in Journal of Bacteriology 193 (15) p4029-4030
- Shimomura Y 2011 in BMC Genomics 12, 17
結核感受性マウスの開発
結核ワクチンに必須である結核菌病原因子及びこれらと特異的に相互作用する宿主防御因子を同定しました。結核菌を用いたマウス感染実験において、野生型マウスでは感染後約150日で半数の個体が死亡するのに対し、この宿主因子遺伝子ノックアウトマウスでは、感染後約75日で半数の個体が死亡しました。さらに、宿主防御因子遺伝子欠損を、結核菌に高感受性系統であるBalb/cに導入したコンジェニック系統をスピードコンジェニック法により作製しました。これらのマウスは結核菌に対する新たな宿主防御機構を明らかにすると共に、より短期間でワクチン効果を効率的に評価することが可能となります。
主要参考文献
- Iwai H 2015 in Tuberculosis 2015 Mar 21. [Epub ahead of print]
- Miyoshi-Akiyama T 2015 in Tuberculosis 95(1): 37-39
