電顕・標本作成支援>受益者負担金>TEM試料作製フロー>組織切片作成フロー
電顕・標本作成支援
共通実験室では、専門の支援員による透過型電子顕微鏡の試料作成支援・組織切片作成支援を行い、センター内の研究者の皆様の連携研究をサポートしています。どうぞお気軽にご相談下さい。
ご依頼の際には、下記の支援業務依頼書をご提出下さい。
受益者負担金について
各種研究支援・機器利用に掛かる消耗品費を受益者負担として、下記のようにご負担頂きます。
※受益者負担金は、各研究部単位で研究所経費から庁費振替いたします。
6月・9月・1月・3月末締めで処理いたします。
| 試料作成支援(ランニングコスト) | 単 価 |
|---|---|
| 1)透過型電子顕微鏡(日本電子 JEM-1400)試料作成支援 ※灌流固定を実施される場合は、固定液の液量により価格が異なりますので、お打ち合わせの際にご相談ください。 |
|
| ・超薄切片作成(固定液準備・樹脂包埋・切片作成・グリッド・電子染色) | 4,000円/検体 |
| ・ネガティブ染色(固定液準備・グリッド・電子染色) | 500円/検体 |
| ・免疫電顕(固定液準備・樹脂包埋・切片作成・グリッド) | 4,000円/検体 |
| 2)走査型電子顕微鏡(日本電子 JSM-IT300)試料作製支援 | |
| ・試料作成(固定液準備・脱水・凍結乾燥・金属蒸着・試料載台) | 2,000円/検体 |
| 3)組織切片作成支援(パラフィン切片/凍結切片共通) | |
| ・ブロック作成 | 500円/ブロック |
| ・HE・PAS-alcianblue・EV・MT・オイルレッドO染色 | 100円/スライドグラス |
| ・免染用 未染色切片(剥離防止コートグラス) | 50円/スライドグラス |
| ※プレパラートケースは、ご必要な場合にのみお付けします。 (100枚入り@1000円・25枚入り@500円) | |
| 機器利用(ランニングコスト) | 単 価 |
|---|---|
| ・フローサイトメーター(シース液・クリーニング液・精度管理用ビーズ) | 1,000円/回 |
| ・レーザーマイクロダイセクション (※専用メンブレンスライドグラス・回収用チューブをご使用の場合のみ) |
2,000円/スライドグラス |
支援実績データの収集にご協力下さい
共通実験室では、皆様のご利用実績に基づいて 今後の支援のあり方やご利用料金の見直し、共通利用機器類の導入要望等を検討して参ります。
当室の研究支援が学会発表・論文などの研究実績に貢献いたしましたら、(i)電顕支援の場合には支援員を共著者として頂き、(ii)組織標本作成支援の場合には謝辞に共通実験室をご利用頂いた旨を明記して下さい。
また、 「学会名(大会開催日時)」・「論文名(雑誌名・発行日・ページ)」の情報を 支援員までお寄せ下さい。
今後の支援体制の向上のために、是非とも皆様のご理解・ご協力を宜しくお願い申し上げます。
透過型電顕用試料作成フロー
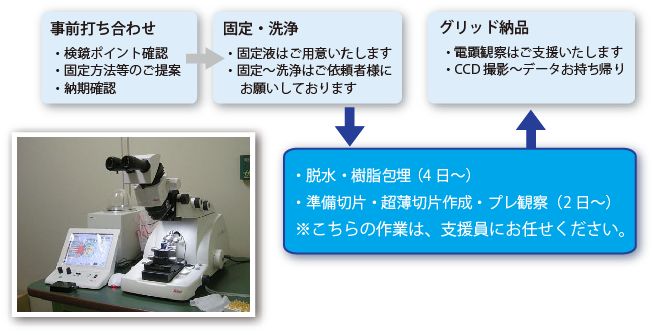
サンプルの固定
ご観察希望の試料それぞれについて、固定液の組成や固定方法を選択する必要があります。お打ち合わせ時に最適なプロトコールをご提案いたします。まずはお気軽にご相談下さい。
固定液は、サンプリング直前に支援員が用時調整し、依頼者にお渡しいたします。
試料に対してたっぷりの固定液の中で、ゆっくりと撹拌しながら固定液を浸透させます。
固定が完了しましたら、洗浄液でよく洗い、支援員にお引き渡し下さい。
※固定液は経時的に劣化してしまいます。固定直前にお渡しできるようにスケジュールをお打ち合わせ下さい。
※固定廃液と洗浄1回目の廃液は、当方でまとめて廃液処理業者に託しますので、支援員にお渡しください。
電子染色~脱水~包埋


固定、洗浄が終わった試料は、支援員にお引き渡し頂いた後、脱水・樹脂包埋いたします。
培養細胞などの場合には、樹脂包埋の前に電子染色を行います。
樹脂包埋よりも前の工程で電子染色するこの方法は「ブロック染色 (en bloc staining)」と呼ばれており、切片の電子染色工程よりも簡便で、且つ切片を汚染・損傷するリスクを避けるというメリットがあります。
電子染色の後は50%EtOHで洗浄し、引き続きEtOHシリーズで脱水します(70%→90%→100%×3回)。
必要に応じて酸化プロピレン(PO)で置換した後、1昼夜かけて樹脂に置換します。
樹脂が十分に浸透した試料は、エポキシ樹脂の場合は60℃で48時間、水溶性樹脂の場合は4℃にて1週間程度UV照射して樹脂重合させます。このとき、試料の形状や方向性(オリエンテーション)を考慮しながら、包埋方法をデザインします。
試料によっては、専用のカプセル内に包埋する場合と、ディッシュなどに培養したまま平板包埋する場合があります。
平板包埋の場合は、必要な部位を糸鋸で切り出して支持台に固定し、剃刀で切削面をトリミングしてから
ウルトラミクロトームで超薄切片を作成します。
70~100nm厚に切った超薄切片は、プラスチック支持膜を張った直径3mmのグリッドに載せます。予めブロック染色を施していない試料の場合は、グリッドに載せた切片を電子染色します。これで検鏡準備完了です。
電顕観察支援
超薄切片の観察準備が整いましたら、支援員がプレ観察し、ご依頼者に大まかな像をお届けいたします。
ご都合の良い時に、実際の電顕像をご自身で是非御覧ください。
電顕観察支援は、平日10:00~17:00の間で随時対応いたします。お気軽にご相談ください。
パラフィン組織切片作成フロー
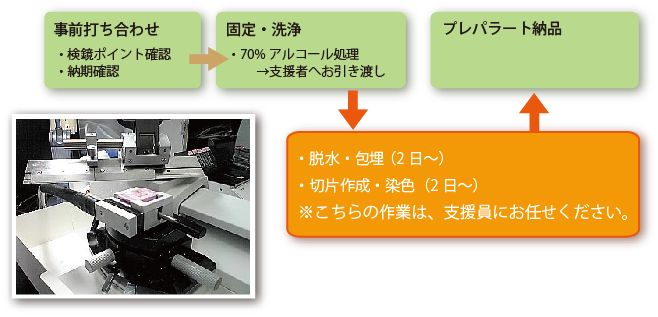
パラフィン組織切片用の固定について

組織切片用の固定には、一般的には10~20%の中性緩衝ホルマリン、4%パラホルムアルデヒドなどのアルデヒド系固定液を用います。
臓器によっては、浸透性の高いピクリン酸を用いたブアン(Bouin)固定が有効な場合もあります。
浸漬固定の場合には、組織への固定液の浸透を良くする工夫が非常に重要です。固定不足は、臓器の内部の組織が崩れたり、染色性の低下を招きます。
固定液の浸透に要する時間は「1mm/時間」程度といわれています。解析に差し支えない程度にメスで割を入れたり、数mm厚程度にスライスしていただきますと、良好な固定結果が得られます。
摘出した臓器を適切な大きさに裁断し、鉛筆でラベルしたヒストカセットにセットし、ビーカーなどに入れたたっぷりの固定液の中で、撹拌しながら固定液を浸透させます。
ヒストカセットはお分けいたしますので、ご遠慮なくお申し出ください。
アルデヒド固定後は、アルデヒド分を除去するために、少なくとも3時間程度流水(またはPBS)で洗浄して下さい。
その後、70%エタノールに浸漬した状態で サンプルをお引き受けいたします。
ブアン固定の場合は、100%エタノールで色抜きしてからご提出下さい。


